Sekvencíranje proteinov
Nizozemsko-ameriška znanstvena naveza v reviji Science poroča o nanopori, s katero so lahko večkrat določili aminokislinsko zaporedje istega proteina. Večkratne meritve istega proteina so namreč močno izboljšale zanesljivost določenega aminokislinskega zaporedja, kar omogoča razlikovanje med zelo podobnimi proteini.
Osnovni gradniki nukleinskih kislin so nukleotidi, pri proteinih pa aminokisline. Molekuli DNK in RNK sestavljajo po štirje različni nukleotidi, proteini pa so sestavljeni iz dvajsetih aminokislin, ki pa jih celice lahko še dodatno kemijsko spreminjajo. Prav te kemijske spremembe aminokislin so marsikdaj ključne za biološke funkcije proteinov.
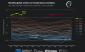
Nukleotidno zaporedje nukleinskih kislin določamo že več desetletij. Ena od sodobnejših tehnologij določanja nukleotidnega zaporedja temelji na nanoporah, majhnih proteinskih luknjicah. Več proteinov se poveže v obroč s poro na sredini, skozi njo pa tečejo ioni, saj je celoten sistem v električnem polju. Pri tej tehnologiji encim, imenovan helikaza, potiska molekulo DNK skozi nanoporo. Molekula DNK deluje kot ovira v pori, zaradi nje se spremeni tok ionov, ki tečejo skozi poro. Tok ionov skozi poro je odvisen od nukleotida, ki se tisti trenutek nahaja v pori – večji ko je nukleotid, bolj ovira tok ionov. Z merjenjem toka ionov je zato mogoče določiti, kateri nukleotid je v določenem trenutku prečkal poro, ti podatki pa nam povedo, kakšno je nukleotidno zaporedje molekule DNK.
Raziskovalna skupina je želela preveriti, ali bi z nanoporami lahko določali tudi aminokisline v proteinih. Najprej so protein, sestavljen iz 26 aminokislin, sklopili s kratko verigo molekule DNK. Verigo DNK so potrebovali zato, da je encim helikaza zagrabil sklopljeno molekulo, saj se veže le na molekulo DNK, ne pa na proteine. Helikaza je najprej skozi poro potisnila verigo DNK, nukleotid za nukleotidom. Ko je prišla do proteina, se ni ustavila, temveč je skozi poro potisnila tudi protein – aminokislino za aminokislino.
Znanstvenice in znanstveniki so z meritvami toka ionov skozi poro ugotovili, da – podobno kot pri nukleotidih – različne aminokisline povzročijo različne spremembe v toku ionov. Da bi razbrali, katera aminokislina je v danem trenutku prečkala poro, so si pomagali s simulacijami molekularne dinamike. Z njimi so izračunali, kolikšen je ionski tok skozi poro, ko je v njej določena aminokislina. Določitev aminokislinskega zaporedja so naredili zanesljivejšo tako, da so analizirali povprečje meritev več prehodov iste molekule skozi nanoporo, in ne le en prehod. Na tak način so lahko zanesljivo razlikovali tudi med dvema proteinoma, ki se med seboj razlikujeta le v eni aminokislini.
Metoda v trenutni obliki ni uporabna za določitev aminokislinskega zaporedja večjih proteinov, je pa dokaz, da je aminokislinsko zaporedje proteinov možno določiti s podobnim konceptom kot pri nukleinskih kislinah.
Aminokisline je skozi poro potiskala Angelika.
























Prikaži Komentarje
Komentiraj